内部审核主要是由实验室自己或以实验室的名义对实验室自身质量管理体系的符合性、有效性、适合性进行审核。审核的依据一般应包括质量管理体系文件及相关质量管理规定。实验室也可根据审核的目的不同来决定审核的依据。实验室通过内部审核是自我诊断、自我完善机制的关键要素,是实验室确保实验室活动准确、可靠、有效的重要保证。
新版认可准则取消了内部审核周期的建议,内部审核的周期和覆盖范围应当基于风险分析。但对于初次申请认可的实验室,CNAS要求实验室体系运行6个月以上,进行过完整的内部审核和管理评审,并能达到预期目的,且所有体系要素应有运行记录内部审核应覆盖CNAS-CL01在相关领域的应用说明。对于如何进行有效的内部审核CNAS-GL011《实验室和检验机构内部审核指南》为实验室如何实施内部审核提供了指导。
内部审核有效性的评价问题
新版准则对内部审核要求的调整,在现场评审中,评审专家关注的要点:
1、内部审核是否为有计划的活动;
2、内部审核方案是否考虑了实验室活动的重要性、影响实验室的变化和以前的审核结果;
3、审校方案是否包括了审核频次、方法、职责、策划要求和报告;
4、是否规定了每次审核的准则和范围;
5、审核过程是否与实验室管理体系或方案要求相匹配;
6、对内部审核发现开出的“不符合”是否针对事实进行了原因分析;
7、采取的纠正措施是否适宜;
8、纠正措施是否有效实施并验证闭环;
9、审核结束后,是否及时总结审核结果,最终向相关管理层报告并保存内部审核记录。
当评审时发现本应由内部审核发现的问题而未能发现,例如管理体系的运行与实验室管理体系文件的规定不符,特别是实验室的规定超出认可准则要求,当这种情况在一个评审中多次发生时,评审组会进一步评审实验室内部审核员的审核能力。
内部审核活动的充分性问题
内部审核是实验室对管理体系进行自我审核,以验证其运作是否持续符合管理体系和相关标准的要求,因此实验室管理体系所涉及的要素和部门都应纳入内部审核范围。由于实验室检测/校准能力和组织结构的差异,不同实验室管理体系所涉及的部门不同,审核覆盖的部门也有所不同。有时,实验室以外的某些部门也可能需要纳人内部审核。
认可准则中 8.8.1 指出“实验室应按照策划的时间间隔进行内部审核,以提供有关管理体系是否符合实验室自身管理体系要求(包括实验室活动)以及符合准则要求的信息”。而在实际认可实践中,实验室内部审核核查表往往是针对认可准则条款的核查,而忽略了是否满足实验室自身要求,也失去了对实验室管理体系文件适用性审查的合适时机。
审核准则是内审员可以依据的一组方针、政策、合同、程序及要求等。内审员在审核中将审核证据与审核的准则进行比较以此来确定不符合。审核准则首先是认可准则,其次是行业标准、法律法规、管理体系文件等(适用时)。
审核的范围为具体的实验室活动、场所、部门及设施,包括实验室外受实验室管理控制的项目、场所、部门及设施设备,如 POCT。
 参考文献:CNAS-GL011-2018实验室和检验机构内部审核指南.pdf
参考文献:CNAS-GL011-2018实验室和检验机构内部审核指南.pdf
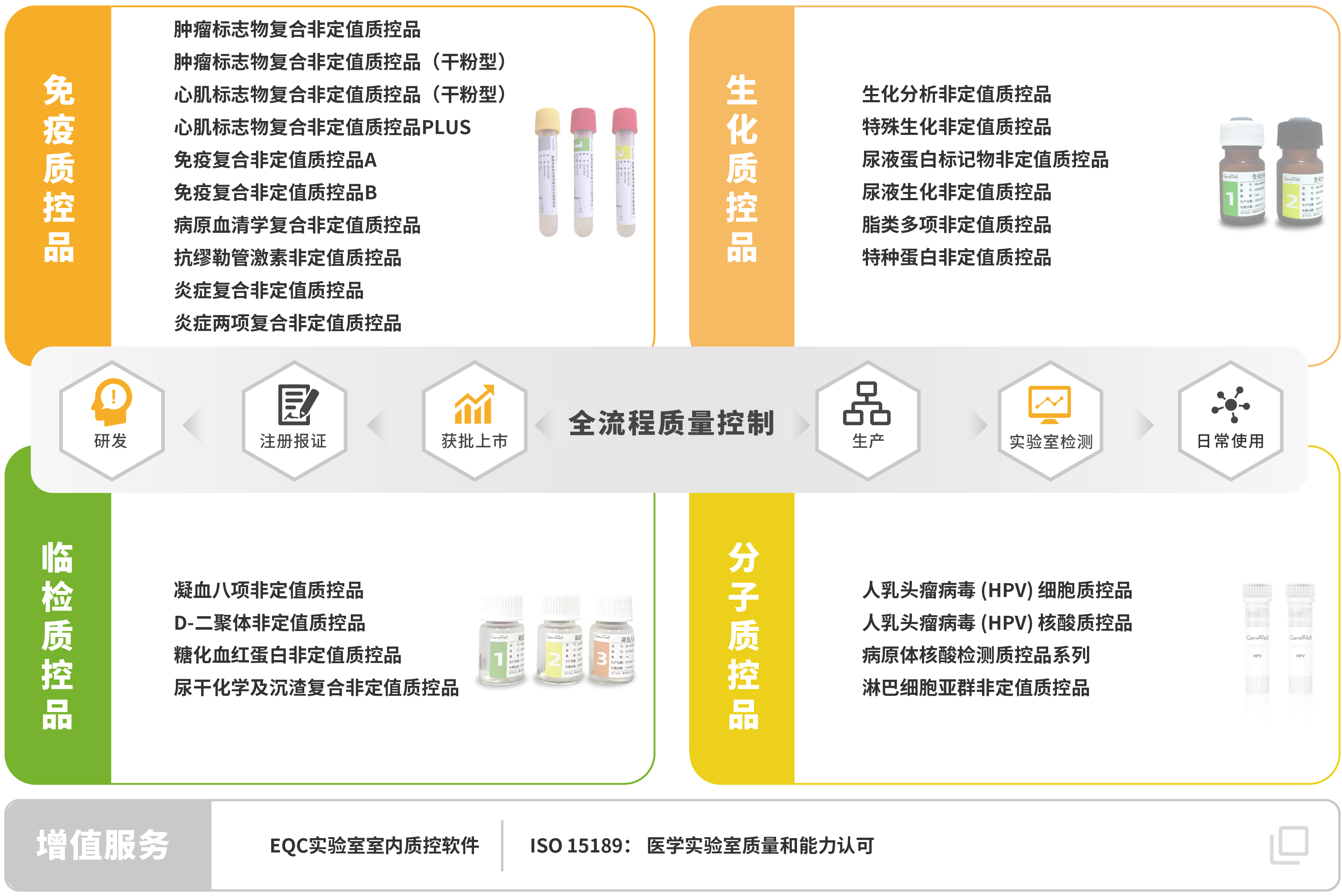
菁良临床质控一站式解决方案
菁良通过自主研发和国产化生产,向体外检测行业用户及合作伙伴提供全球领先的临床实验室质量控制解决方案,协助医学实验室实现全面质量管理。现已推出专业的质控管理软件,第三方质控品涵盖免疫诊断、生化诊断、分子诊断等体外诊断细分领域。
关于菁良
菁良科技(深圳)有限公司是全球领先的提供体外诊断标准品与质控品的研发创新型高科技企业。
菁良通过自主研发的平台,向体外检测行业用户及合作伙伴提供全球领先的标准物质、第三方质控产品和企业参考品服务,助力提高行业检测准确率。参与多项由检测领域行业龙头和监管机构发起的标准制定工作,多次支持由临检中心发起的室间质量评价 (EQA)/能力验证项目。
菁良秉承着“精准制标,匠心良造”的理念,怀抱着“提高体外检测准确率,助力精准医学快速发展”的愿景,致力于建立规范化的中国体外检测金标准平台。
